Правило за фазите
За информацията в тази статия или раздел не са посочени източници. Въпросната информация може да е непълна, неточна или изцяло невярна. Имайте предвид, че това може да стане причина за изтриването на цялата статия или раздел. |
Правилото за фазите на Уилард Гибс свързва броя на фазите в една термодинамична система в равновесие с броя на нейните компоненти и степените ѝ на свобода. То гласи:
Степените на свобода F на една система са равни на броя на компонентите C минус броя на фазите в равновесие P плюс две.
Степен на свобода се нарича броя на параметрите (температура, налягане, концентрация), които могат да се променят свободно (независимо един от друг), без да се наруши равновесието в системата и някоя от фазите да изчезне.
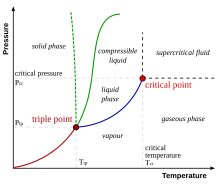
Една еднокомпонентна система (C=1), състояща се от две фази в равновесие (P=2), напр. вода в равновесие с водна пара, има една степен на свобода (F=1). Само един от параметрите може да се променя независимо (в известни граници) без да изчезне една от фазите. Например в посочената система само температурата или налягането може да се промени, другият параметър е зададен от фазовото равновесие (виж фазова диаграма). В една еднокомпонентна система може да има максимално три фази в равновесие: твърда, течна и газообразна. В този случай броят на степените на свобода е нула. Т.е. ако който и да е от параметрите на системата се промени една или две от фазите ще изчезнат. Температурата и налягането при което има три равновесни фази дефинират т.нар. тройна точка. За водата стойностите им са съответно 611,657 (± 0,010) Pa und 273,16 K (0,01 °C).