Валденово обръщане
Валденовото обръщане представлява завъртане на атом или група около хиралния център една молекула в резултат на химична реакция. Понеже за всеки хирален център в молекула могат да се формират по два енантиомера (виж оптични изомери), при Валденовото обръщане се говори за прескачане от единия оптичен изомер (енантиомер) към другия. Например при реакция на нуклеофилно заместване тип SN2, Валденовото обръщането възниква при тетраедричния C-атом. Това може да се представи като си представим чадър обърнат наоопаки (от вътре навън) при много силен вятър.
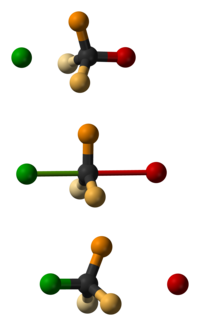
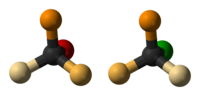
За първи път това обръщане е забелязано през 1896 г. от химикът Поул Валден. Той успял да преврне единият оптичен изомер (енантиомер) на някакво химическо съединение в другия оптичен изомер отново и отново, което било наречено Валденов цикъл. Валденовият цикъл протича ей така: Започва се от (+) янтарна киселина (1 от схемата). При третиране със сребърен оксид и вода протича нуклеофилно заместване и хлорният атом от киселината се замества с -OH група. При тази реакция се запазва оптичната структура, а получената киселина с добавена хидроксилна група се нарича (+) хидроксиянтарна киселина (2). После хидроксиянтарната киселина се третира с PCl5, като закачената -OH група от преди малко се замества нуклеофилно от хлорен атом, но тук първоначалната оптичната структура не се запазва и се получава пак янтарна киселина (3), но с оптична структура различна от първоначалната. После третиране отново със сребърен оксид дава (-) хидроксиянтарна киселина (4), отново с различна оптична структура в сравнение с хидрокси-киселината от предималко. Изомерната хидроксиянтрарна киселина след продължително третиране с PCl5 дава „оригиналната“ янтарна киселина от началото и така цикълът се връща в начална позиция.[1]
В първата стъпка от реакцията сребърният оксид е важен щото е донор на -OH, самото среброто на практика не е важно. Междинните продукти са карбоксилният дианион A който дава интрамолекулярния нуклеофилен заместител на 4-членния β-лактонен пръстен B. Другата карбиксилна група също е реактивна, но данните от компютърни симулации (in silico) показват, че добивът на преходната форма на 3-членния α-лактон е много висок. Хидроксилно-йонен пръстен отваря отново лактонът към алкохол C и свързания ефект на двете при задържане на конфигурацията (преводът ми е доста лош, който разбира тази абзац може да го редактира).[2]
Вижте също
редактиране- Друга демонстрация на Валденов цикъл при Бруковата реорганизация (Brook rearrangement)
Източници
редактиране| Тази страница частично или изцяло представлява превод на страницата Walden inversion в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |
