Соленост на океанската и морската вода
Солеността е химическа характеристика на водата във водните басейни. Тя представлява количеството соли, което се съдържа в един кубичен метър вода. Мерната единица, с която се изразява солевото съдържание, е промил.
Соли
редактиранеОкеанската и морската вода имат особено солено-горчив вкус. Това се дължи на различните соли в нея. Преобладаващият солен вкус на водата се дължи на готварската сол, а горчивият вкус – на магнезиевите соли. В 1 l (1000 g) морска вода се съдържат средно около 35 g соли (27,2 g се падат на готварската сол). Всичките соли в морската вода в постоянно процентно съотношение, независимо от количеството им. Това процентно съотношение се запазва и тогава, когато морската вода се разрежда с прясна вода. Солите в морската вода процентно са разпределени по следния начин: NaCl – 77,8%, MgCl2 – 10,9%, MgSO4 – 4,7%, CaSO4 – 3,6%, K2SO4 – 2,4%, CaCO3 – 0,3%, MgBr2 – 0,2%, други соли – 0,1%. Или в 100 kg морски соли се съдържат близо 78 kg готварска сол, 11 kg магнезиев хлорид и 11 kg други соли (около 35 вида).[2]
Установено е, че докато в речната вода преобладават карбонатите, в океанската и морската вода първо място заемат хлоридите. По-малкият процент на карбонатните соли в океанската и морската вода се дължи на извънредно голямото изразходване на тези соли за изграждане скелетите и черупките на многобройните океански и морски обитатели. След тяхното измиране черупките и скелетите им падат на дъното на моретата и океаните, където се натрупват в дебели пластове. От това може да се направи извод, че съотношението на солите в океанската и морската вода непрекъснато се регулира от соленоводните организми.[2]
Фактори за солеността на океанската и морската вода
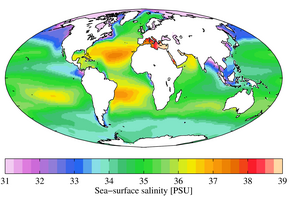
редактиранеСредната соленост на водите в Световния океан е около 35‰. Това количество обаче показва големи отклонение за различните части на океаните и за отделните морета. Това отклонение се дължи на влиянието на валежите, на притока на речни води, на изпарението и заледяването, на топенето на ледовете и на различни биологични процеси.
Солеността на океанската и морската вода намалява в онези части, където валежите са по-обилни, а речните води – в местата (или моретата), където се вливат големи реки. Например в Черно море, където се влива река Дунав и други големи реки, а изпарението не е много интензивно, солеността на водата е около 18‰. Обратно, в Червено море, където няма приток на речни води, а изпарението е много голямо, солеността на водата достига 42‰. Частите от Световния океан, които се намират около устията на големите реки Конго, Амазонка, Мисисипи и др., също имат намалена соленост на своите води. На някои места този ефект се чувства до 500 km навътре в океана.
Изпарението и замръзването на океанската вода е причина за увеличение на солеността ѝ. В тропичните пояси на океаните, където изпарението е интензивно, а валежите оскъдни, солеността на водата е относително най-голяма. Заледяването има значение за солеността на водите в Северния ледовит океан и за водите около Антарктида.
Океанските и морските води се делят на полусолени и солени. За полусолени се приемат онези води, чиято соленост и от 0,5 до 24,5‰. Тези води се наричат още бракични. За солени води се приемат още онези, които имат соленост от 24,5 до 42‰. Водите със соленост над 42‰ се разглеждат като пресолени (водите на Мъртво море имат соленост 230‰[3], в залива Карабогаз гол на Каспийско море – 200‰), а водите, които соленост под 0,5‰ се приемат за пресни.[2]
Разпределение на солеността в океаните и моретата в хоризонтална и вертикална посока
редактиранеРазпределението на солеността в океаните и моретата зависи главно от климатичните условия и до известна степен от ролята на морските течения. Особено голямо значение за количеството на солите в океанската и морската вода има изпарението или притокът на прясна вода. Изпарението е най-силно в местата с високи температури и постоянни силни ветрове, и е най-слабо в местата с ниски температури и затишие. Ако притокът на прясна вода е по-голям от изпарението, количеството на солите намалява. Обратно, ако изпарението надвишава притока на прясна вода, количеството им се увеличава.[2]
Между разпределението на климатичните пояси и на солите в океанската и морската вода се забелязва известна закономерност. В областта на пасатите океанската и морската вода съдържа най-много соли (36 – 37‰). В крайбрежните райони, където има приток на прясна вода, солите са по-малко (32 – 34‰). На север и на юг от областта на пасатите съдържанието на соли в океанската и морската вода постепенно намалява и става по-малко от средното. То е още по-малко в полярните райони на Северното и на Южното полукълбо поради слабото изпарение и притока на прясна вода при разтапянето на ледниците. Топлите течения, които идват от малките географски ширини и се насочват към полярните басейни (например Гълфстрийм), допринасят за увеличаване на солите, а студените течения, които идват от полярните басейни (Източногренландско течение), допринасят за намаляване на солите на океанската вода.[2]
В дълбочина количеството на солите в океанската вода постепенно се изравнява. Докато в повърхностните води в Северния ледовит океан количеството на солите е 30‰, а в областта на пасатите е 37‰, на дълбочина под 3000 m тяхното количество от полюсите до екватора е 35‰.
Значително колебание на солите се наблюдава и в моретата. Водата в онези морета, които са заобиколени със сухи и горещи области (пустини, полупустини и други), имат повече соли (Средиземно море – 37 – 39‰, Червено море – 39 – 41‰). Обратно – водата на моретата, разположени в по-влажни климатични пояси или в които се вливат големи пресноводни реки, има по-малко соли (Азовско море – 10 – 12‰, Балтийско море – 8 – 12‰, Черно море – 17 – 18‰).[2]
Източници
редактиране- ↑ World Ocean Atlas 2009. nodc.noaa.gov
- ↑ а б в г д е «Обща физическа география, С., 1977 г.» – Химични свойства на океанската и морската вода, стр. 142 – 146
- ↑ Anati, D. A. The salinity of hypersaline brines: concepts and misconceptions // Int. J. Salt Lake. Res. 8. 1999. DOI:10.1007/bf02442137. с. 55 – 70.