Пепсин
Пепсинът е ендопептидаза, която разгражда протеините на по-малки пептиди. Произвежда се в стомаха и е един от основните храносмилателни ензими в храносмилателната система на хората и много животни, които спомагат за усвояването на протеините в храната. Пепсинът е аспарагинова протеаза, използваща каталитичен аспартат в активния си център.[1]
| Пепсин A | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
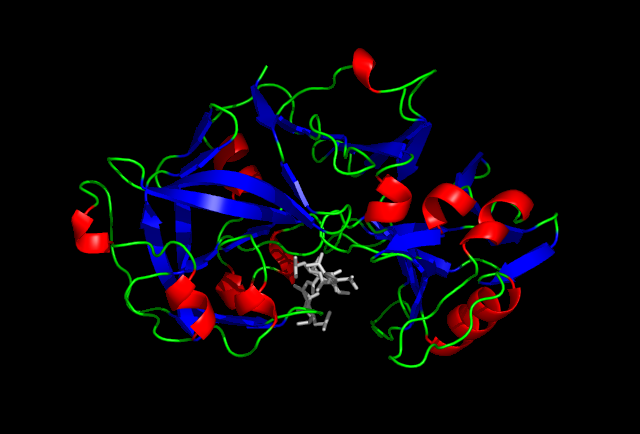
| Пепсин в комплекс с пепстатин. | |||||||
| Характеристики | |||||||
| Идентификатори | |||||||
| EC номер | |||||||
| CAS номер | 9001-75-6 | ||||||
| Бази данни | |||||||
| IntEnz | |||||||
| BRENDA | |||||||
| ExPASy | |||||||
| KEGG | |||||||
| MetaCyc | |||||||
| PRIAM | |||||||
| PDB | |||||||
| Генна онтология | |||||||
| |||||||
| Пепсин B | |||||||
|---|---|---|---|---|---|---|---|
| Характеристики | |||||||
| Идентификатори | |||||||
| EC номер | |||||||
| CAS номер | 9025-48-3 | ||||||
| Бази данни | |||||||
| IntEnz | |||||||
| BRENDA | |||||||
| ExPASy | |||||||
| KEGG | |||||||
| MetaCyc | |||||||
| PRIAM | |||||||
| PDB | |||||||
| |||||||
| Пепсин C | |||||||
|---|---|---|---|---|---|---|---|
| Характеристики | |||||||
| Идентификатори | |||||||
| EC номер | |||||||
| CAS номер | 9012-71-9 | ||||||
| Бази данни | |||||||
| IntEnz | |||||||
| BRENDA | |||||||
| ExPASy | |||||||
| KEGG | |||||||
| MetaCyc | |||||||
| PRIAM | |||||||
| PDB | |||||||
| |||||||
Това е една от трите основни протеази в човешката храносмилателна система (другите две са химотрипсин и трипсин). В хода на храносмилането тези ензими, всеки от които е специализиран в прекъсването на връзките между отделните видове аминокиселини, си сътрудничат в разграждането на хранителните протеини до съставните им компоненти (например пептиди и аминокиселини), които могат да се абсорбират от тънкото черво. Пепсинът е най-ефективен при разкъсването на пептидните връзки между хидрофобните и ароматните аминокиселини, като например фенилаланин, триптофан и тирозин.[2]
Проензимът на пепсина, пепсиноген, се отделя от главните клетки в стомашната стена и, след като се смеси със солната киселина на стомашния сок, пепсиногенът се активира, превръщайки се в пепсин.[1]
История редактиране
Пепсинът е един от първите открити ензими и по природа е полипептиден. Открит е през 1836 г. от Теодор Шван. Той измисля термина от старогръцката дума πέψις (пепсис), означаваща „смилане“.[3][4][5] По това време учените започват да откриват много биохимични съединения, които играят значителна роля в биологичните процеси, а пепсинът е един от тях. Пепсинът се оказва киселинно вещество, което е в състояние да преобразува храните с азот във водоразтворим материал.[6]
През 1928 г. пепсинът става един от първите ензими, които са кристализирани, когато Джон Нортроп го кристализира чрез диализа, филтрация и охлаждане.[7]
Прекурсор редактиране
Пепсинът има генна експресия като проензим, наречен пепсиноген, чиято главна структура има 44 допълнителни аминокиселини. Пепсиногенът се отделя от главните клетки в стомаха. Той се активира от солната киселина, която се отделя от париеталните клетки. Хормонът гастрин и блуждаещият нерв задействат отделянето както на пепсиноген, така и на солна киселина (HCl) от стомаха, когато храна навлезе в него. Солната киселина създава киселинна среда, която позволява на пепсиногенът да се разгъне и отцепи по автокаталитичен начин, като по този начин се генерира пепсин в активна форма. Пепсинът разцепва 44-те аминокиселини на пепсиногена, за да създаде още пепсин.
Активност и стабилност редактиране
Пепсинът е най-активен в киселинна среда с температура между 37 °C и 42 °C.[8][9] Съответно, неговото първоначално място на синтез и активност е в стомаха (pH от 1,5 до 2). Пепсинът усвоява до 20% от погълнатите амидни връзки, като се разцепва преференциално в С-терминалната страна[10]:с. 96 на аромарните аминокиселини.[10]:с. 675 Пепсинът проявява преференциално разцепване за хидрофобни и ароматни остатъци в позиции Р1 и Р1'. Повишена чувствителност към хидролиза се получава, когато има сяро-съдържаща аминокиселина, близка до пептидната връзка, която има ароматна аминокиселина. Пепсинът разцепва Phe1Val, Gln4His, Glu13Ala, Ala14Leu, Leu15Tyr, Tyr16Leu, Gly23Phe, Phe24 в B-веригата на инсулина. Пепсинът е най-активен при pH 2 и е неактивен над pH 6,5. При над pH 8 пепсинът е напълно денатуриран и необратимо дезактивиран.[11] Следователно, пепсин в разтвор с рН до 8 може да се реактивира отново при повторно окисляване. Стабилността на пепсина при високо рН има значителни последствия върху фаринголарингеалния рефлукс. Пепсинът остава в ларинкса след стомашен рефлукс.[12][13] При средното рН на ларингофаринкса (рН = 6.8) пепсинът би бил неактивен, но би могъл да се реактивира при последващи събития на киселинен рефлукс, което води до увреждане на местните тъкани. Пепсинът е един от основните причинители на увреждане на лигавицата по време на рефлукса.[14][15]
Обикновено дебитът на пепсина при мъжете е около 20 – 30 mg/час при основна секреция, като може да достигне 60 – 80 mg/час при стимулирана секреция чрез пентагастрин. При жените секрецията обикновено е с 25 – 30% по-малка.
Инхибитори редактиране
Пепсинът може да се инхибира при високи нива на pH или чрез инхибиторни вещества. Пепстатинът е съединение с ниско молекулно тегло и мощен инхибитор специално за киселинни протеази с Ki от около 10−10 M за пепсин. Счита се, че статиловият остатък на пепстатина е отговорен за инхибирането на пепсина. Пепстатинът не се свързва ковалентно с пепсина и, следователно, инхибирането на пепсин чрез пепстатин е обратимо.[16]
Пепсин претърпява и инхибиране чрез обратна връзка – продуктът за разграждане на протеини забавя реакцията чрез инхибиране на пепсина.[17][18] Сукралфатът също забавя действието на пепсина.
Приложение редактиране
Пепсинът за търговски цели се извлича от жлезистия слой на свински стомаси. Той е съставка на сирищете, което се използва за стягане на млякото при производството на сирене. Пепсинът се използва за различни цели при производството на храни: за модифициране и осигуряване на качества на соевия протеин и желатина,[19] за модифициране на зеленчуковите протеини, за направата на полуготови зърнени закуски и за приготвяне на животински и растителни протеинови хидролизати, които се използват за ароматизиране на храни и напитки. Използва се и в кожарската промишленост за премахване на козина и остатъчни тъкани от кожи и за възстановяване на сребро от изхвърлени фотографски филми чрез смилане на желатиновия слой, в който се съдържа среброто.[20] В миналото се е използвал и като добавка към някои дъвки.
Източници редактиране
- ↑ а б Enzyme entry 3.4.23.1 // Swiss Institute of Bioinformatics. Посетен на 14 декември 2008.
- ↑ Overview of pepsin-like aspartic peptidases // Current Protocols in Protein Science Chapter 21 (1). November 2001. ISBN 0471140864. DOI:10.1002/0471140864.ps2103s25. с. Unit 21.3.
- ↑ [Discovery of pepsin by Theodor Schwann] // Revue Medicale De Liege 12 (5). март 1957. с. 139 – 44.
- ↑ Asimov, Isaac. A short history of biology. Westport, Conn, Greenwood Press, 1980. ISBN 9780313225833. с. 95.
- ↑ Harper, D. Pepsin
- ↑ A history of pepsin and related enzymes // The Quarterly Review of Biology 77 (2). юни 2002. DOI:10.1086/340729. с. 127 – 47.
- ↑ Crystalline pepsin // Science 69 (1796). May 1929. DOI:10.1126/science.69.1796.580. с. 580.
- ↑ Effects of pH // Worthington Biochemical Corporation. Посетен на 29 април 2010.
- ↑ Information on EC 3.4.23.1 – pepsin A // BRENDA-enzymes. Посетен на 14 декември 2008.
- ↑ а б Cox, Michael, Nelson, David R., Lehninger, Albert L. Lehninger principles of biochemistry. San Francisco, W.H. Freeman, 2008. ISBN 0-7167-7108-X.
- ↑ Activity/stability of human pepsin: implications for reflux attributed laryngeal disease // The Laryngoscope 117 (6). юни2007. DOI:10.1097/MLG.0b013e31804154c3. с. 1036 – 9.
- ↑ Pepsin and carbonic anhydrase isoenzyme III as diagnostic markers for laryngopharyngeal reflux disease // The Laryngoscope 114 (12). декември 2004. DOI:10.1097/01.mlg.0000149445.07146.03. с. 2129 – 34.
- ↑ Effect of pepsin on laryngeal stress protein (Sep70, Sep53, and Hsp70) response: role in laryngopharyngeal reflux disease // The Annals of Otology, Rhinology, and Laryngology 115 (1). януари 2006. DOI:10.1177/000348940611500108. с. 47 – 58.
- ↑ Role of acid and pepsin in acute experimental esophagitis // Gastroenterology 56 (2). февруари 1969. с. 223 – 30.
- ↑ Role of the components of the gastroduodenal contents in experimental acid esophagitis // Surgery 92 (2). август 1982. с. 276 – 84.
- ↑ Pepstatin inhibition mechanism // Advances in Experimental Medicine and Biology 95. 1977. DOI:10.1007/978-1-4757-0719-9_12. с. 199 – 210.
- ↑ The story of the isolation of crystalline pepsin and trypsin // The Scientific Monthly 35 (4). 1932. с. 333 – 340.
- ↑ The inhibition of pepsin-catalysed reactions by products and product analogues. Kinetic evidence for ordered release of products // The Biochemical Journal 113 (2). юни 1969. DOI:10.1042/bj1130363. с. 363 – 8.
- ↑ Kun, Lee Yuan. Microbial Biotechnology: Principles And Applications. 2nd. Singapore, World Scientific Publishing Company, 2006. ISBN 981-256-677-5.
- ↑ GELATINASE AND THE GATES-GILMAN-COWGILL METHOD OF PEPSIN ESTIMATION // The Journal of General Physiology 17 (1). септември 1933. DOI:10.1085/jgp.17.1.35. с. 35 – 40.