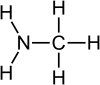
Метиламин
Метиламинът е органично съединение с химична формула CH3NH2. Представлява безцветен газ, дериват на амоняка, при който един водороден атом е заменен от метилова група. Това е най-простият амин. Продава се разтворен в метанол, етанол, тетрахидрофуран или вода или като безводен газ в метални контейнери под налягане. Има силен рибен мирис. Метиламинът е съставна част при синтеза на много комерсиално значими съединения.
| Метиламин | |||||
| |||||
| Имена | |||||
|---|---|---|---|---|---|
| По IUPAC | Метанамин | ||||
| Други | Аминометан Монометиламин | ||||
| Свойства | |||||
| Формула | CH5N | ||||
| Моларна маса | 31,058 g·mol−1 | ||||
| Външен вид | безцветен газ | ||||
| Плътност | 656,2 kg/m3 | ||||
| Точка на топене | −93,10 °C | ||||
| Точка на кипене | между −6,6 и −6,0 °C | ||||
| Парно налягане | 186,10 kPa | ||||
| Разтворимост във вода | 1,008 g.L−1 | ||||
| pKa | 10,62 (неизв.) | ||||
| pKb | 3,36 | ||||
| Магнитна възприемчивост | -27,0·10−6 cm3/mol | ||||
| Диполен момент | 1,31 D | ||||
| Термохимия | |||||
| Стандартна енталпия на образуване | −23,5 kJ mol−1 | ||||
| Опасности | |||||
| NFPA 704 |
| ||||
| Точка на запалване | −10 °C | ||||
| Точка на самозапалване | 430 °C | ||||
| LD50 | 100 mg kg−1(плъх) | ||||
| Идентификатори | |||||
| CAS номер | 74-89-5 | ||||
| PubChem | 6329 | ||||
| ChemSpider | 6089 | ||||
| Номер на ЕК | 200-820-0 | ||||
| Номер на ООН | 1061 | ||||
| DrugBank | DB01828 | ||||
| KEGG | C00218 | ||||
| MeSH | methylamine | ||||
| ChEBI | 16830 | ||||
| ChEMBL | 43280 | ||||
| RTECS | PF6300000 | ||||
| SMILES | CN | ||||
| InChI | 1S/CH5N/c1-2/h2H2,1H3 | ||||
| InChI ключ | BAVYZALUXZFZLV-UHFFFAOYSA-N | ||||
| Beilstein | 741851 | ||||
| UNII | BSF23SJ79E | ||||
| Gmelin | 145 | ||||
| 3DMet | B00060 | ||||
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |||||
| Метиламин в Общомедия | |||||
При вдишване, метиламинът причинява силно дразнене на кожата, очите и горните дихателни пътища. Вдишването му отначало води до възбуда, а след това до потискане на централната нервна система.
Промишлено производство
редактиранеМетиламин се приготвя чрез взаимодействие на амоняк с метанол или в присъствието на алуминосиликатен катализатор. Като вторични продукти се получават диметиламин и триметиламин. Кинетиката на реакцията и съотношенията на реагентите определят съотношенията на трите продукта. Най-благоприятстван от кинетиката е триметиламинът.[1]
- CH3OH + NH3 → CH3NH2 + H2O
По този начин, през 2005 г. са произведени около 115 000 тона метиламин.[2]
Лабораторен метод
редактиранеМетиламин е получен за пръв път през 1849 г. от Шарл Адолф Вюрц чрез хидролиза на метил изоцианат и сродни съединения.[2][3] Пример за този процес включва употребата на пренареждане на Хофман, при което се получава метиламин от ацетамид и бром.[4][5]
В лабораторни условия, метиламин хидрохлорид може да се получи чрез различни методи. Един от методите включва обработването на формалдехид с амониев хлорид.[6]
- NH4Cl + H2CO → [CH2=NH2]Cl + H2O
- [CH2=NH2]Cl + H2CO + H2O → [CH3NH3]Cl + HCO2H
Безцветната хидрохлоридна сол може да се превърне в амин чрез добавяне на силна основа, като например натриев хидроксид (NaOH):
- [CH3NH3]Cl + NaOH → CH3NH2 + NaCl + H2O
Друг метод включва редукция на нитрометан с цинк и солна киселина.[7]
Реактивност и приложения
редактиранеМетиламинът е добър нуклеофил, тъй като е безпрепятствен амин.[8] Като амин се счита за слаба основа. Употребата му в органичната химия е широко разпространена. Реагира с фосген до метилизоцианат, с въглероден дисулфид и натриев хидроксид до натриев метилдитиокарбамат, с хлороформ и основа до метилизоцианид и с етилен оксид до метилетанолалмини. Течният метиламин има свойство на разтворител, аналогично на течния амоняк.[9]
Комерсиално значимите химикали, произвеждани от метиламин, включват лекарства като ефедрин и теофилин и пестициди като карбофуран, карбарил и метам натрий. Приготвянето на някои повърхностно активни вещества и фотографски проявители изисква метиламин.[2]
В САЩ, метиламинът попада под регулацията на Администрацията за борба с наркотиците (DEA), тъй като може да се използва като прекурсор при производството на метамфетамин.[10][11]
В популярната култура
редактиранеВ сериала В обувките на Сатаната, протагонистът Уолтър Уайт произвежда метамфетамин чрез редуктивно аминиране на фенилацетон с метиламин. Той и сътрудникът му, Джеси Пинкман, крадат метиламин в първи и в пети сезон на сериала.
Източници
редактиране- ↑ Methylamines synthesis: A review // Catalysis Today 37 (24). 1997. DOI:10.1016/S0920-5861(97)00003-5. с. 71 – 102.
- ↑ а б в Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke „Amines, Aliphatic“ in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI:10.1002/14356007.a02_001
- ↑ Charles-Adolphe Wurtz (1849) "Sur une série d'alcalis organiques homologues avec l'ammoniaque" (On a series of homologous organic alkalis containing ammonia), Comptes rendus …, 28 : 223 – 226. Note: Wurtz's empirical formula for methylamine is incorrect because chemists in that era used an incorrect atomic mass for carbon (6 instead of 12).
- ↑ Mann, F. G., Saunders, B. C. Practical Organic Chemistry, 4th Ed. London, Longman, 1960. ISBN 9780582444072. с. 128.
- ↑ Cohen, Julius. Practical Organic Chemistry 2nd Ed. London, Macmillan and Co., Limited, 1900. с. 72.
- ↑ Methylamine Hydrochloride // Org. Synth. 1941.; Coll. Vol., 1, 347
- ↑ Laboratory Methods of Organic Chemistry. Edinburgh, UK, R & R Clark, Limited, 1937. с. 157 – 158.
- ↑ Linker Strategies in Solid-Phase Organic Synthesis. с. 80.
- ↑ Debacker, Marc G. и др. The Lithium−Sodium−Methylamine System: Does a Low-Melting Sodide Become a Liquid Metal? // Journal of the American Chemical Society 118 (8). 1996. DOI:10.1021/ja952634p. с. 1997.
- ↑ Title 21 Code of Federal Regulations // Архивиран от оригинала на 2017-10-17. Посетен на 2020-04-12.
- ↑ Frank, R. S. The Clandestine Drug Laboratory Situation in the United States // Journal of Forensic Sciences 28. 1983. DOI:10.1520/JFS12235J. с. 12235J.