Естествен изотоп
В геохимията и ядрената физика, естествени изотопи или първични изотопи (наричани още естествени елементи, или първични елементи) са изотопи на химични елементи открити по Земята, съществуващи в тяхното сегашно състояние, още преди формирането на Земята. Естествените елементи са били налични в междузвездните среди преди формирането на Слънчевата система. Формирането им се е случило при Големия взрив, при нуклеосинтезa в звездите, при избухването на свръхнови, последвано от изхвърляне на голямо количество маса, както и при други космически процеси. Естествените елементи включват всички стабилни изотопи, както и някои изотопи на радиоактивни елементи с период на полуразпад по-дълъг от възрастта на Земята. Познати са 286 естествени изотопа.
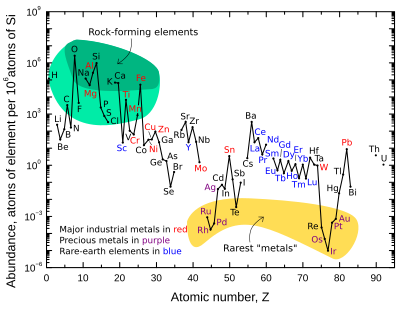
Всички 253 стабилни изотопи са в категорията на естествените елементи, както и 33 радиоизотопа, които се смятат за естествени. Примери за такива радиоизотопи са:
- кадмий – 113Cd, 116Cd
- телур – 128Te, 130Te
- неодим – 144Nd, 150Nd
- самарий – 147Sm, 148Sm
- уран – 235U и 238U.
Тъй като възрастта на Земята е около 4,6 милиарда години, това значи, че периода на полуразпад на посочените изотопи трябва да надвишава 1,00×108 години (100 милиона години) от практически съображения. Например, за изотоп с период на полуразпад 60 милиона години, спрямо възрастта на Земята, означава че са минали 77 периода на полуразпад. В случая, от един мол на даден изотоп наличен при формирането на Земята, след 77 цикъла са останали само 4 атома.
Естествените елементи, често се срещат, като два или повече първични изотопа и затова се смята, че общият брой на естествените химични елементи е 83. Осемдесет от елементите имат поне един стабилен изотоп, а останалите три имат само радиоизотопи. Това са бисмута, тория, и урана.
Природно срещащи се нуклиди, които не са естествени
редактиранеНякои нестабилни изотопи, които се срещат в природата, като 14С, 3H, 239Pu не са естествени, но биват постоянно възобновявани. Това възобновяване се случва, посредством космическа радиация, или при процесите на алфа- и бета-разпад (полоний, радон, радий, нептуний и т.н.) или трансмутация на естествени елементи, като урана и тория. Всички изотопи на елементи получени по този начин, имат много по-малък период на полуразпад, от тези на естествените елементи, от които са получени.
Около 51 нуклида, които са радиоактивни и се срещат в природата, не са естествени. С тях броят на наличните изотопи в Земята е около 340.
Естествени елементи
редактиранеИма около 253 стабилни естествени нуклиди и 33 естествени радионуклиди, но само 80 стабилни естествени елемента (1 до 82 – от водород до олово, с изключение на елементите с номера 43 и 61 – технеций и прометий) и три радиоактивни естествени елемента – бисмут, торий и уран. Периодът на полуразпад на бисмута е толкова дълъг, че той често е смятан, като практически стабилен елемент. Неговата радиоактивност е твърде ниска, за да се смята за опасна. Броят на естествените елементи е по-малък от броя на естествените нуклиди, тъй като повечето елементи имат повече от един естествен нуклид.
Таблица на естествените радионуклиди и техните периоди на полуразпад
редактиранеКакто вече беше споменато по-горе има 33 радионуклиди, които са естествени. Някои химични елементи, като кадмия, неодима, самария, телура и урана имат по 2 естествени нуклида. Изброените радионуклиди са подредени по големина на периода на полуразпад, т.е. тези с най-дълъг период са първи в списъка. Тези радионуклиди са почти наравно по разпространеност спрямо стабилните изотопи на изброените елементи.
За три от елементите, радионуклидът надминава разпространеността на стабилния изотоп на дадения елемент. Такива нуклиди са тези на телура, индия и рения.
| № | Нуклид | Енергия | Период на полуразпад | Начин на разпад | Енергия на разпад | Период на полуразпад спрямо възрастта на вселената |
|---|---|---|---|---|---|---|
| 254 | 128Te | 8,743261 | 2,2 × 1024 | 2 β− | 2,530 | 160 билиона |
| 255 | 78Kr | 9,022349 | 9,2 × 1021 | ЕЕ | 2,846 | 670 милиарда |
| 256 | 136Xe | 8,706805 | 2,165 × 1021 | 2 β− | 2,462 | 150 милиарда |
| 257 | 76Ge | 9,034656 | 1,8 × 1021 | 2 β− | 2,039 | 130 милиарда |
| 258 | 130Ba | 8,742574 | 1,2 × 1021 | ЕЕ | 2,620 | 90 милиарда |
| 259 | 82Se | 9,017596 | 1,1 × 1020 | 2 β− | 2,995 | 8 милиарда |
| 260 | 116Cd | 8,836146 | 3,102 × 1019 | 2 β− | 2,809 | 2 милиарда |
| 261 | 48Ca | 8,992452 | 2,301 × 1019 | 2 β− | 4,274 | 2 милиарда |
| 262 | 96Zr | 8,961359 | 2,0 × 1019 | 2 β− | 3,4 | 1 милиард |
| 263 | 209Bi | 8,158689 | 1,9 × 1019 | α | 3,137 | 1 милиард |
| 264 | 130Te | 8,766578 | 8,806 × 1018 | 2 β− | 0,868 | 600 милиона |
| 265 | 150Nd | 8,562594 | 7,905 × 1018 | 2 β− | 3,367 | 600 милиона |
| 266 | 100Mo | 8,933167 | 7,804 × 1018 | 2 β− | 3,035 | 600 милиона |
| 267 | 151Eu | 8,565759 | 5,004 × 1018 | α | 1,9644 | 300 милиона |
| 268 | 180W | 8,347127 | 1,801 × 1018 | α | 2,509 | 100 милиона |
| 269 | 50V | 9,055759 | 1,4 × 1017 | β+ или β− | 2,205; 1,038 | 10 милиона |
| 270 | 113Cd | 8,859372 | 7,7 × 1015 | β− | 0,321 | 600 000 |
| 271 | 148Sm | 8,607423 | 7,005 × 1015 | α | 1,986 | 500 000 |
| 272 | 144Nd | 8,652947 | 2,292 × 1015 | α | 1,905 | 200 000 |
| 273 | 186Os | 8,302508 | 2,002 × 1015 | α | 2,823 | 100 000 |
| 274 | 174Hf | 8,392287 | 2,002 × 1015 | α | 2,497 | 100 000 |
| 275 | 115In | 8,849910 | 4,4 × 1014 | β− | 0,499 | 30 000 |
| 276 | 152Gd | 8,562868 | 1,1 × 1014 | α | 2,203 | 8000 |
| 277 | 190Pt | 8,267764 | 6,5 × 1011 | α | 3,252 | 60 |
| 278 | 147Sm | 8,610593 | 1,061 × 1011 | α | 2,310 | 8 |
| 279 | 138La | 8,698320 | 1,021 × 1011 | Е или β− | 1,737; 1,044 | 7 |
| 280 | 87Rb | 9,043718 | 4,972 × 1010 | β− | 0,283 | 4 |
| 281 | 187Re | 8,291732 | 4,122 × 1010 | β− или α | 0,0026; 1,653 | 3 |
| 282 | 176Lu | 8,374665 | 3,764 × 1010 | β− | 1,193 | 3 |
| 283 | 232Th | 7,918533 | 1,406 × 1010 | α или СД | 4,083 | 1 |
| 284 | 238U | 7,872551 | 4,471 × 109 | α или СД или 2 β− | 4,270 | 0,3 |
| 285 | 40K | 8,909707 | 1,25 × 109 | β− или Е или β+ | 1,311; 1,505; 1,505 | 0,09 |
| 286 | 235U | 7,897198 | 7,04 × 108 | α или СД | 4,679 | 0,05 |
Пояснение на таблицата
редактиране- №
Текущият зададен номер на нуклида. Тези числа могат да варират, тъй като от смятаните за момента стабилни изотопи се очаква, да се открие такъв, който при по-задълбочено проучване може да се окаже нестабилен, т.е. радионуклид. Такъв пример от миналото е 209Bi, който дълго време е бил смятан за стабилен изотоп, но впоследствие през 2003 г. се разбира, че е радионуклид.
- Нуклид
Нуклидното число представлява масовото число на съответния елемент.
- Енергия
Тази колона отбелязва масата на ядрото на нуклида, спрямо масата на неутроните на нуклида.
- Период на полуразпад
Всички дадени стойности са в години.
- Начин на разпад
| α | α разпад |
| β− | β− разпад |
| Е | електронен захват |
| ЕЕ | двоен електронен захват |
| β+ | β+ разпад |
| СД | спонтанно делене |
| 2 β− | двоен β− разпад |
| 2 β+ | двоен β+ разпад |
| И | изомерен преход |
| П | протонен разпад |
| Н | неутронен разпад |
- Енергия на разпада
Няколко различни стойности за енергията на разпад (MeV) са дадени за различните начини на разпад. Дадените стойности следват поредността на изброяване на начина на разпад.
- Период на полуразпад спрямо възрастта на вселената
Дадените стойности са в пъти.
Вижте също
редактиранеИзточници
редактиране| Тази страница частично или изцяло представлява превод на страницата Primordial nuclide в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |